來源:網絡資源 2022-11-02 13:04:41
鈉及其化合物
一、鈉的物理性質
1.顏色:銀白色、有金屬光澤。
2.密度:鈉、水和煤油的密度大小為ρ(水)>ρ(鈉)>ρ(煤油)。
3.熔點:小于(填“大于”“小于”或“等于”)100 ℃。
4.硬度:質地較軟。
二、從原子結構認識鈉的化學性質——還原性

1.鈉與非金屬單質反應
(1)與O2反應
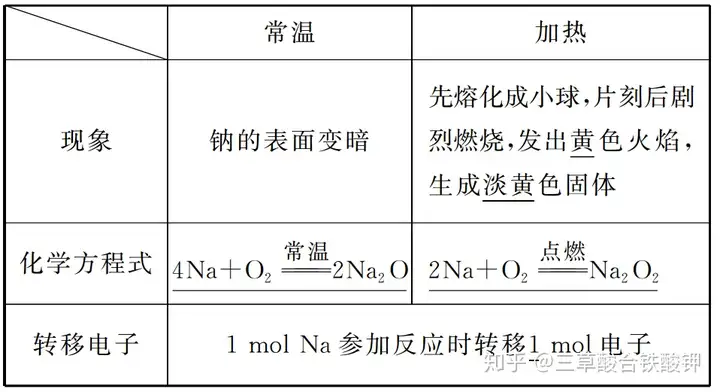
(2)與Cl2反應的化學方程式:2Na+Cl2點燃(=====)2NaCl。
(3)與S反應的化學方程式:2Na+S△(=====)Na2S。
2.鈉與水、鹽溶液的反應
(1)鈉與水的反應
①鈉與水反應的離子方程式:2Na+2H2O===2Na++2OH-+H2↑。
②鈉與水(含酚酞)反應的實驗現象及解釋:

(2)鈉與鹽溶液的反應
Na先和水反應生成NaOH再與鹽溶液反應,并判斷是否發生復分解反應
如鈉投入CuSO4溶液中,反應的離子方程式為2Na+2H2O+Cu2+===2Na++Cu(OH)2↓+H2↑。
鈉投入BaCl2溶液中,反應的化學方程式為2Na+2H2O===2NaOH+H2↑。
3.鈉與鹽酸的反應
鈉與鹽酸反應的離子方程式為2Na+2H+===2Na++H2↑
三、鈉的制取、保存及用途
1.制取:化學方程式為2NaCl(熔融)通電(=====)2Na+Cl2↑。
2.保存:密封保存,通常保存在石蠟油或煤油中。
3.用途
(1)鈉、鉀合金(液態)可用于原子反應堆的導熱劑。
(2)作強還原劑,將某些稀有金屬從它們的鹵化物中還原出來,如4Na+TiCl4熔融(=====)Ti+4NaCl。
(3)用作電光源,制作高壓鈉燈。
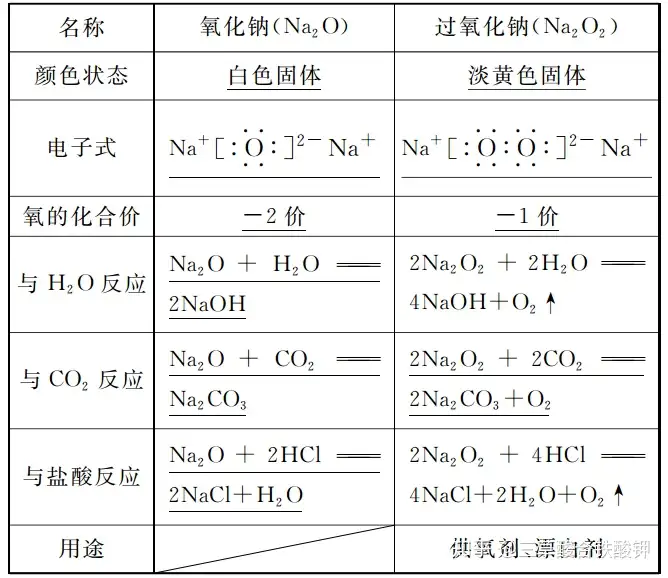
四、氧化鈉與過氧化鈉的比較
總結
1.鈉的取用方法:用鑷子夾取一小塊鈉,用濾紙吸干表面的煤油,用小刀切取黃豆大小的鈉,剩余的鈉放回試劑瓶。
2.鈉失火的處理:沙土蓋滅,不能用水或泡沫滅火器滅火。
3.Na2O2中氧元素的化合價為-1價而不是-2價。
4.Na2O2晶體中陰、陽離子個數比為1∶2而不是1∶1。
5.過氧化鈉與還原性溶液反應的化學方程式的書寫步驟:
第一步:Na2O2與溶液中的水反應生成NaOH和O2;
第二步:反應生成的O2與還原性鹽發生氧化還原反應;
第三步:將上述兩個反應的化學方程式合并,即得總的化學方程式。
6.Na2O2與H2O、CO2反應的兩個常見誤區
(1)Na2O2與H2O、CO2反應都是自身的氧化還原反應;
(2)1 mol Na2O2與足量CO2或H2O發生反應時,轉移的電子數是NA而不是2NA。
1.金屬鈉與鹽或堿溶液反應的思維模板

2.金屬鈉與溶液反應現象分析思維模板
(1)共性:因為鈉與不同的水溶液反應均屬于劇烈的置換反應,故有共同的現象產生:①浮:鈉浮在液面上;②熔:鈉熔化成光亮的小球;③游:在液面上不停地游動直至反應完;④響:反應中不停地發出“嘶嘶”的響聲。
(2)差異性:與酸、強酸弱堿鹽溶液反應時,由于溶液中H+濃度較大,反應比與水還要劇烈,最后鈉可能在液面上燃燒;與鹽溶液反應時,還可能會生成沉淀(如生成難溶堿)、氣體(NH3)等。
1.鈉與氧氣反應的產物與反應溫度有關,加熱或點燃產物是過氧化鈉。
2.不管生成氧化鈉還是過氧化鈉,金屬鈉失電子均變為+1價的陽離子,因而等量的鈉完全反應失去的電子數相同
1.有關Na2O2與CO2、H2O的反應的幾個重要關系
2CO2+2Na2O2===2Na2CO3+O2
2H2O+2Na2O2===4NaOH+O2↑
(1)物質的量的關系
無論是CO2或H2O的單一物質還是二者的混合物,通過足量的Na2O2時,CO2或H2O與放出O2的物質的量之比均為2∶1。
(2)氣體體積關系
若CO2和水蒸氣的混合氣體(或單一氣體)通過足量Na2O2,氣體體積的減少量等于原混合氣體體積的2(1)且等于生成氧氣的體積。
(3)電子轉移關系
當Na2O2與CO2、H2O反應時,物質的量關系為2Na2O2~O2~2e-。
(4)固體質量關系
相當于固體(Na2O2)只吸收了CO2中的“CO”,H2O中的“H2”;可以看作發生相應的反應:Na2O2+CO===Na2CO3、Na2O2+H2===2NaOH(實際上兩反應不能發生)。
(5)先后順序關系
一定量的Na2O2與一定量的CO2和H2O(g)的混合物的反應,可視作Na2O2先與CO2反應,待CO2反應完成后,Na2O2再與H2O(g)發生反應。
2.增重量等于可燃物質量的規律
凡分子組成符合(CO)m·(H2)n的物質,Wg該物質在O2中完全燃燒,將其產物(CO2和水蒸氣)通過足量的Na2O2后,固體增重必為Wg。或是由C、H、O三種元素組成的物質,只要C、O原子個數比為1∶1,即可滿足該條件。
中學階段常見的符合這一關系的物質有:
(1)無機物:H2、CO及H2和CO的混合氣體。
(2)有機物:CH3OH(甲醇)、HCHO(甲醛)、CH3COOH(乙酸)、HCOOCH3(甲酸甲酯)、C6H12O6(葡萄糖)等。
過氧化鈉的強氧化性
1.Na2O2與SO2反應:Na2O2+SO2===Na2SO4。
2.Na2O2投入FeCl2溶液中,可將Fe2+氧化成Fe3+,同時生成Fe(OH)3沉淀。
3.Na2O2投入氫硫酸中,可將H2S氧化成單質硫,溶液變渾濁。
4.Na2O2投入Na2SO3溶液中,可將SO3(2-)氧化成SO4(2-)。
5.Na2O2具有漂白性,投入品紅溶液中,可使品紅溶液褪色
鈉的重要化合物
1.碳酸鈉和碳酸氫鈉

2.鈉及其重要化合物間的轉化關系

圖中帶標號的有關反應的化學方程式:
①2Na+O2點燃Na2O2;
②2Na+2H2O===2NaOH+H2↑;
③2Na2O2+2H2O===4NaOH+O2↑;
④2Na2O2+2CO2===2Na2CO3+O2;
⑤2NaOH+CO2===Na2CO3+H2O;
⑥2NaCl+2H2O電解2NaOH+Cl2↑+H2↑。
3.Na2CO3的制備及用途
(1)Na2CO3的工業制備——侯氏制堿法
①制備原理
把二氧化碳通入氨的氯化鈉飽和溶液中,使溶解度較小的碳酸氫鈉從溶液中析出,過濾得到碳酸氫鈉晶體,碳酸氫鈉受熱分解生成碳酸鈉。
②反應的化學方程式
a.NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl;
b.2NaHCO3△(=====)Na2CO3+CO2↑+H2O。
(2)Na2CO3、NaHCO3的用途
①Na2CO3是一種非常重要的化工原料,在玻璃、肥皂、合成洗滌劑、造紙、紡織、石油、冶金、食品等工業中有著廣泛的應用。
②NaHCO3是焙制糕點所用的發酵粉的主要成分之一;在醫療上,它是治療胃酸過多的一種藥劑。
4.Na2CO3和NaHCO3的比較
(1)Na2CO3、NaHCO3的鑒別
①若為固體
可利用加熱法。加熱產生使澄清石灰水變渾濁的氣體的是NaHCO3。
②若為溶液
可利用沉淀法。加入BaCl2溶液,產生白色沉淀的是Na2CO3;也可利用氣體法。滴加稀鹽酸,立即產生氣泡的是NaHCO3,開始無氣泡產生的是Na2CO3。
(2)Na2CO3、NaHCO3和鹽酸的反應
Na2CO3溶液和稀鹽酸反應可理解為分步反應:
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3溶液和稀鹽酸反應的化學方程式為
NaHCO3+HCl===NaCl+CO2↑+H2O
①放出CO2的速率
NaHCO3溶液與鹽酸反應放出CO2的速率快。
②Na2CO3溶液與鹽酸的互滴鑒別
向Na2CO3溶液中逐滴加入鹽酸,開始無氣泡產生,而向鹽酸中滴加Na2CO3溶液,開始就有氣泡產生。
③CO2生成量比較
a.等物質的量的Na2CO3、NaHCO3分別與足量的鹽酸反應,產生的CO2相等。
b.等質量的Na2CO3、NaHCO3分別與足量的鹽酸反應,NaHCO3產生的CO2多。
c.等量的鹽酸與足量的Na2CO3、NaHCO3分別反應,NaHCO3產生的CO2多。
d.一定量的NaHCO3受熱分解產生的CO2量與受熱分解后的殘留物與鹽酸反應產生的CO2量相等。
5.數形結合思想理解Na2CO3、NaHCO3與鹽酸的反應
(1)鹽酸逐滴加入Na2CO3溶液中(鹽酸不足時)
①現象:開始無明顯現象,后有無色氣體放出。
②反應:無明顯現象時反應的離子方程式:CO3(2-)+H+===HCO3(-),有無色氣體放出時反應的離子方程式:HCO3(-)+H+===CO2↑+H2O。
(2)Na2CO3溶液逐滴加入稀鹽酸中(鹽酸過量時)
①現象:有無色氣體放出。鑒別Na2CO3、NaHCO3的常用方法
②反應的離子方程式:CO3(2-)+2H+===CO2↑+H2O。
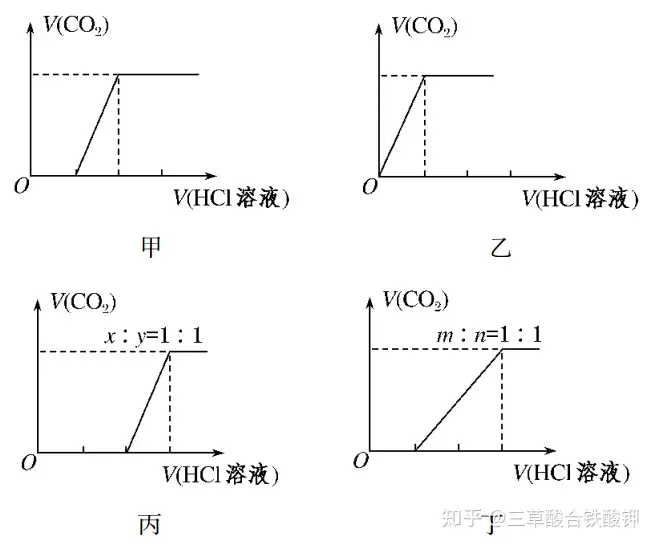
(3)碳酸鈉、碳酸氫鈉與鹽酸反應的基本圖象
①向Na2CO3中逐滴加入鹽酸,消耗HCl溶液的體積與產生CO2的體積的關系如圖甲所示。
②向NaHCO3中逐滴加入鹽酸,消耗HCl溶液的體積與產生CO2的體積的關系如圖乙所示。
③向NaOH、Na2CO3的混合物中逐滴加入鹽酸,消耗HCl溶液的體積與產生CO2的體積的關系如圖丙所示(設NaOH、Na2CO3的物質的量之比為x∶y=1∶1,其他比例時的圖象略)。
④向Na2CO3、NaHCO3的混合物中逐滴加入鹽酸,消耗HCl溶液的體積與產生CO2的體積的關系如圖丁所示(設Na2CO3、NaHCO3的物質的量之比為m∶n=1∶1,其他比例時的圖象略)。
鑒別Na2CO3、NaHCO3的常用方法

歡迎使用手機、平板等移動設備訪問中考網,2025中考一路陪伴同行!>>點擊查看
B闂傚倸鍊搁崐鎼佸磹妞嬪海鐭嗗〒姘e亾妤犵偛顦甸弫鎾绘偐閸愯弓缃曟繝寰锋澘鈧洟骞婃惔銏╂敯闂傚倷鑳剁划顖炲礉閺囥垹绠规い鎰╁€栭崰鍡涙煥閺囩偛鈧綊鎮¢妷鈺傜厽闁哄洨鍋涢埀顒€婀遍埀顒佺啲閹凤拷
C闂傚倸鍊搁崐鎼佸磹閹间礁纾归柣鎴eГ閸婂潡鏌ㄩ弴姘舵濞存粌缍婇弻娑㈠箛閸忓摜鏁栭梺娲诲幗閹瑰洭骞冨Δ鍛瀭妞ゆ劑鍊栭幉娆愮節濞堝灝鏋熷┑鐐诧躬瀵濡搁埡鍌氫簽闂佺ǹ鏈粙鎴︻敂閿燂拷闂傚倸鍊搁崐鎼佸磹閻戣姤鍤勯柛顐f礀缁犵娀鏌熼崜褏甯涢柛瀣ㄥ€濋弻鏇熺箾閻愵剚鐝旂紓浣插亾濠㈣泛顑囩粻楣冩煕閳╁叐鎴犱焊椤撶姷纾奸柍褜鍓熷畷鎺楁倷鐎电ǹ寮抽梻浣虹帛濞叉牠宕愰崷顓涘亾濮樼偓瀚�闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌i姀鈶跺湱澹曟繝姘厵闁告挆鍛闂佺粯鎸婚悷褏妲愰幒鏂哄亾閿濆骸浜滄い鏇熺矒閺岀喖鎯傞崫銉滈梺鍝勭焿缂嶄線鐛▎鎾崇妞ゆ巻鍋撴い蹇ユ嫹闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌i姀鈶跺湱澹曟繝姘厵闁告挆鍛闂佺粯鎸婚悷褏妲愰幒鏂哄亾閿濆簼绨藉ù鐘灪閵囧嫰骞掔€n亞浼勯梺璇″櫘閸o綁寮幘缁樻櫢闁跨噦鎷�
D濠电姷鏁告慨鐑藉极閸涘﹥鍙忓ù鍏兼綑閸ㄥ倻鎲搁悧鍫濈瑲闁稿顦甸弻鏇$疀鐎n亖鍋撻弴銏㈠祦闁靛骏绱曠粻楣冩煕閳╁厾顏堟倿妤e啯鐓曢柣鏇炲€圭€氾拷
F缂傚倸鍊搁崐鎼佸磹閹间礁纾瑰瀣捣閻棗銆掑锝呬壕閻庤娲橀崝娆忕暦椤愶箑唯闁挎洍鍋撻幖鏉戯躬濮婇缚銇愰幒鎴滃枈闂佸摜濮靛畝鎼佸箖閾忣偆绡€婵﹩鍘鹃崣鍡涙⒑缂佹ɑ绀€闁稿﹤婀遍埀顒佺啲閹凤拷
G婵犵數濮撮惀澶愬级鎼存挸浜炬俊銈勭劍閸欏繘鏌i幋锝嗩棄缁惧墽绮换娑㈠箣濞嗗繒浠鹃梺绋匡龚閸╂牜鎹㈠┑瀣棃婵炴垶鑹鹃埅閬嶆⒑缂佹ḿ鐭婃い顓犲厴瀵濡搁埡鍌氫簽闂佺ǹ鏈粙鎴︻敂閿燂拷
H闂傚倸鍊搁崐鎼佸磹妞嬪海鐭嗗〒姘e亾妤犵偞鐗犻、鏇氱秴闁搞儯鍔庨々鐑芥倵閿濆簼绨婚柛瀣Ч濮婃椽宕楅懖鈹垮仦闂佸搫鎳忕换鍫ュ箖閾忣偆绡€婵﹩鍘鹃崣鍡涙⒑缂佹ɑ绀€闁稿﹤婀遍埀顒佺啲閹凤拷闂傚倸鍊搁崐鎼佸磹妞嬪海鐭嗗〒姘e亾妤犵偛顦甸弫鎾绘偐閸愬弶鐤勫┑掳鍊х徊浠嬪疮椤栫偛纾婚悗锝庡枟閻撴瑩鏌eΔ鈧悧濠勬閼碱剛妫柟顖嗗瞼鍚嬮梺鍝勮閸旀垿骞冮妶澶婄<婵炴垶锕╂导锟�
J婵犵數濮烽弫鍛婃叏閻戣棄鏋侀柟闂寸绾惧鏌i幇顒€鏂€缂傚倹纰嶇换娑㈠幢濡搫袝濠电偛鐗忛弲顐ゆ閹烘柡鍋撻敐搴″箺缁绢厼鐖奸弻锟犲幢椤撶姷鏆ら梺鍝勮閸旀垿骞冮妶澶婄<婵炴垶锕╂导锟�
N闂傚倸鍊搁崐鎼佸磹妞嬪海鐭嗗〒姘e亾妤犵偛顦甸弫鎾绘偐椤旂懓浜鹃柛鎰靛枛楠炪垺绻涢幋鐑嗙劯闁挎洖鍊归悡鐔兼煙闁箑澧柟顖氱墦閹嘲鈻庡▎鎴犳殼闂佸搫琚崝鎴﹀箖閵堝纾兼繛鎴烇供娴硷拷闂傚倸鍊搁崐宄懊归崶顒夋晪鐟滄棃寮绘繝鍥ㄦ櫜濠㈣泛锕﹂崝锕€顪冮妶鍡楃瑐闁煎啿鐖兼俊鎾箳濡や胶鍘遍梺鍝勫€藉▔鏇熸櫏闂備浇顕栭崰妤佺仚缂備胶濮甸惄顖涗繆閻戣姤鏅濋柍褜鍓熼、鏃堟晸閿燂拷
Q闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵稿妽闁稿顑呴埞鎴︽偐閹绘帩浠鹃梺鍝勬缁捇寮婚悢鍏煎€绘慨妤€妫欓悾鐑芥⒑缁嬪灝顒㈡い銊ワ躬瀵濡搁埡鍌氫簽闂佺ǹ鏈粙鎴︻敂閿燂拷
S濠电姷鏁告慨鐑藉极閹间礁纾婚柣鎰惈閸ㄥ倿鏌涢锝嗙缂佺姳鍗抽弻鐔兼⒒鐎电ǹ濡介梺鍝勬噺缁诲牓寮婚弴鐔风窞闁糕剝蓱閻濇梻绱撴担鍝勑i柣鎿勭節瀵濡搁埡鍌氫簽闂佺ǹ鏈粙鎴︻敂閿燂拷婵犵數濮烽弫鍛婃叏閻戣棄鏋侀柟闂寸绾惧潡鏌熺€电ǹ孝缂佽翰鍊濋弻锕€螣娓氼垱楔闂佸搫妫撮梽鍕Φ閸曨垰绠抽柛鈩冦仦婢规洟姊绘担鐟邦嚋婵炴彃绻樺畷瑙勭鐎n亝鐎梺鐟板⒔缁垶寮查幖浣圭叆闁绘洖鍊圭€氾拷闂傚倸鍊搁崐鎼佸磹瀹勬噴褰掑炊閵娧呭骄闂佸壊鍋侀崕娲极鐎n剚鍠愰煫鍥ㄧ☉缁犳煡鏌曡箛瀣偓鏇犵不濞戞瑣浜滈柡鍌氱仢閳锋梹顨ラ悙瀛樺磳婵﹨娅i幑鍕Ω閵夛妇褰氶梻浣烘嚀閸ゆ牠骞忛敓锟�婵犵數濮烽弫鍛婃叏閻戣棄鏋侀柟闂寸绾剧粯绻涢幋娆忕仾闁搞倖鍔栭妵鍕冀椤愵澀娌梺绋款儏椤戝寮婚悢鍏煎€锋い鎺戝€婚悰顕€姊洪幐搴g畵妞わ缚鍗冲鏌ュ箹娴e湱鍙嗛梺缁樻礀閸婂湱鈧熬鎷�闂傚倸鍊搁崐鎼佸磹閻戣姤鍊块柨鏇楀亾妞ゎ亜鍟村畷绋课旈埀顒勫磼閵娿儮鏀介柛灞剧氨瑜版帗鍋い鏇楀亾闁哄本绋栭ˇ铏亜閵娿儳绠荤€殿噮鍋呯换婵嬪礋閵娿儰澹曞Δ鐘靛仜閻忔繈宕濆顓濈箚妞ゆ劧绲块幊鍥┾偓瑙勬礃濞茬喖骞冮姀銈呯闁兼祴鏅涘鎶芥⒒娴h櫣甯涙繛鍙夌墵瀹曟劙宕烽娑樹壕婵ḿ鍋撶€氾拷
T濠电姷鏁告慨鐑藉极閸涘﹥鍙忓ù鍏兼綑閸ㄥ倻鎲搁悧鍫濈瑲闁稿﹤鐖奸弻娑㈩敃閻樻彃濮庨梺姹囧€楅崑鎾舵崲濠靛洨绡€闁稿本绋戝▍銈夋⒑閸濄儱孝婵☆偅绻堝濠氬Ω閳哄倸浜為梺绋挎湰缁嬫垿顢旈敓锟�濠电姷鏁告慨鐑藉极閸涘﹥鍙忓ù鍏兼綑閸ㄥ倸霉閻樿尙鎲柣鎴f绾惧吋绻涢幋鐐插毈婵炶尙枪閳规垿鎮╃拠褍浼愰梺鐟板暱缁绘ê顕i崘娴嬪牚闁割偆鍠撻崣鍡涙⒑缂佹ɑ绀€闁稿﹤婀遍埀顒佺啲閹凤拷
W婵犵數濮烽弫鍛婃叏閻㈠壊鏁婇柡宥庡幖缁愭淇婇妶鍛殲鐎规洘鐓¢弻鐔煎箥椤旂⒈鏆梺鎶芥敱濡啴寮诲☉銏犲嵆闁靛ǹ鍎虫禒顓㈡⒑缁嬪灝顒㈤柛銊ユ健瀵濡搁埡鍌氫簽闂佺ǹ鏈粙鎴︻敂閿燂拷闂傚倸鍊搁崐鎼佸磹妞嬪海鐭嗗〒姘e亾妤犵偞鐗犻、鏇㈡晝閳ь剟鎮块鈧弻锝呂旈埀顒勬偋韫囨洜涓嶅Δ锝呭暞閻撳啰鎲稿⿰鍫濈闁绘梻鍘ч拑鐔兼煃閳轰礁鏆熼柣鐔烘嚀閳规垿鎮╅幓鎺撴濡炪倕楠忛幏锟�
X闂傚倸鍊搁崐宄懊归崶褏鏆﹂柣銏⑶圭粣妤呮煙閹峰苯鐒介柍褜鍓欓崯鏉戠暦閵娧€鍋撳☉娅亪鍩€椤掑啫鐓愮紒缁樼箞濡啫鈽夐崡鐐插闂備胶枪椤戝倿寮查悩璇茶摕闁靛ň鏅滈崑鍡涙煕鐏炲墽鈽夋い蹇ユ嫹
Z闂傚倸鍊搁崐鎼佸磹閹间礁纾瑰瀣椤愪粙鏌ㄩ悢鍝勑㈢紒鎰殕娣囧﹪濡堕崨顔兼闂佹悶鍔岄崐鍧楀蓟閿濆顫呴柕蹇婂墲濮e嫰姊虹紒妯肩煀妞ゎ厾鍏樺濠氬Ω閳哄倸浜為梺绋挎湰缁嬫垿顢旈敓锟�