來源:網(wǎng)絡(luò)資源 2022-11-14 16:42:05
以下內(nèi)容涉及到 初高中常見物質(zhì)的實驗室制法,主要以基本教學內(nèi)容中的各類物質(zhì)的制取為主,輔以樓主認為需要掌握的物質(zhì)實驗室制法。接下來我將會把教科書上涉及制取的方法一一羅列,同時也會指出題目中出現(xiàn)常見問題。
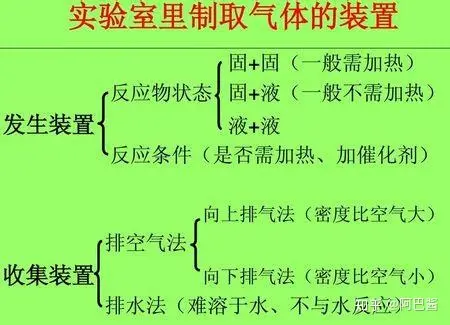
下面是初中范圍內(nèi)的三種氣體(氧氣 氫氣 二氧化碳)的實驗室制法。正式介紹之前先介紹一下制取氣體的裝置。
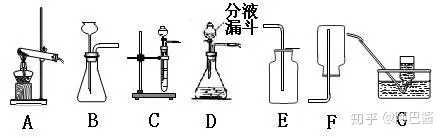
上圖中 A為固固加熱型 C為固液不加熱型 B D既可以用作固液不加熱也可以用作固液加熱型
實驗室的二氧化碳制法:
塊狀大理石(或石灰石)和稀鹽酸反應(yīng)。反應(yīng)方程式為:CaCO3+2HCl==CaCl2+H2O+CO2↑
(注:該反應(yīng)也是實驗室制取氯化鈣的方法)
反應(yīng)裝置:固固不加熱型
氣體中主要雜質(zhì):氯化氫氣體以及水蒸氣 除去方法:依次通過 飽和碳酸氫鈉溶液 和 濃硫酸洗氣 收集方法:向上排空氣法或排飽和碳酸氫鈉溶液法
改進方法:教科書中使用的是B裝置,我們可以用上圖的C或者D裝置對其進行改進。(注:改進后能反應(yīng)是否進行)
常見問題:
1.為什么用塊狀大理石(或石灰石)而不用純凈的碳酸鈣固體? 答:相比較塊狀大理石(或石灰石)因其含有雜質(zhì)而使反應(yīng)比碳酸鈣固體更快
2.為什么反應(yīng)物要選擇塊狀而非粉末狀? 答:粉末狀反應(yīng)速率過快不利于二氧化碳的收集。(不選用濃鹽酸亦同理)
實驗室的氧氣制法:
相對于雙氧水制取氧氣,考試時更注重氯酸鉀和高錳酸鉀加熱分解制取氧氣的操作。
(I.)雙氧水在二氧化錳做催化劑下分解,反應(yīng)方程式:
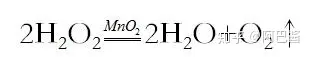
收集方法:向上排空氣法或排水集氣法
實驗裝置:固液不加熱型。裝置可以選用 B C D,但是C D更好
提純:制取干燥的氧氣流用濃硫酸(堿石灰、無水氯化鈣等)進行洗氣。【排水集氣法就不用干燥了】
(II.)氯化鉀在二氧化錳作催化劑加熱條件下制取氧氣。
化學方程式:
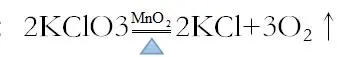
實驗裝置:固固加熱型,上圖的A裝置
實驗裝置的氣密性檢查:將A裝置裝配好后,將導氣管移入水中,微熱試管。待試管恢復常溫后,導氣管中出現(xiàn)一段穩(wěn)定的水柱則證明氣密性完好。
實驗裝置的放置要求:試管口應(yīng)微微向下(原因:氯酸鉀藥品可能受潮,加熱時有水蒸氣在試管中冷凝,若試管微微向上,冷凝的水會匯聚在試管底部從而使玻璃因溫度驟變而爆裂)
(III.)加熱高錳酸鉀制取氧氣
化學方程式:
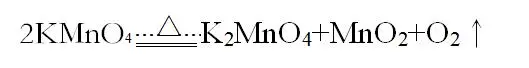
實驗裝置:固固加熱型
檢查氣密性同(II.)
實驗裝置的放置要求:1、試管口應(yīng)微微向下。2、試管口應(yīng)該放一團棉花(防止反應(yīng)過于劇烈使高錳酸鉀進入導氣管而堵塞導氣管;對于排水集氣法,還有就是防止高錳酸鉀進入水溶液影響觀察)
常見問題:
1、若實驗室要用氯酸鉀制取氧氣而,恰好沒有二氧化錳固體,則可以用什么什么藥品代替二氧化錳? 答:高錳酸鉀。原因:高錳酸鉀加熱分解出氧氣和二氧化錳,生成的二氧化錳又催化氯酸鉀分解)
2、在(II.)和(III.)實驗完成后,如何回收催化劑二氧化錳。 答:向試管中加入足量水溶解后過濾并烘干濾渣
3、在題(2)中,玻璃棒的作用是什么,漏斗的放置有什么要求? 答:引流;漏斗下端應(yīng)貼緊燒杯杯壁
【注】對于催化雙氧水分解,我做到比較多的題目是比較 過氧化氫酶、二氧化錳和氯化鐵 的催化效果強弱。結(jié)論為:催化效率 過氧化氫酶>二氧化錳>氯化鐵
實驗室的氫氣制法
粗鋅粒和稀硫酸反應(yīng)
化學反應(yīng)方式:Zn+H2SO4==ZnSO4+H2↑
實驗裝置:固液不加熱型(上圖裝置的B C D, 當然是更推薦C D)
氣密性檢查:(見 氯化鉀在二氧化錳作催化劑加熱條件下制取氧氣)
收集方法:排水集氣法或向下排空氣法
制取氣體中所含雜質(zhì):水蒸氣
除去方法:濃硫酸洗氣
特殊要求:制取氫氣時要先驗純
檢驗方法:先收集一小試管,再在空氣中點燃,若出現(xiàn)淡藍色火焰并聽到輕微爆鳴聲則證明氫氣純凈(嚴格的說是較為純凈)
常見問題:
1、為什么實驗室常使用粗鋅粒而不適用純鋅、粉末狀、或者鐵 鋁來制取氫氣? 答:粗鋅粒的反應(yīng)速率適中,便于收集。
2、在上述反應(yīng)發(fā)生時,可以采取什么方法使反應(yīng)速率加快? 答:適當增加硫酸濃度;使用鋅粉;在反應(yīng)時滴入幾滴硫酸銅(初中范圍內(nèi)不要求掌握,了解一下就可以了,原理在高中化學蘇教版必修二中會提及:鋅粒表面形成Zn—Cu原電池加快了反應(yīng)的進行)
3、如果將稀硫酸換成稀鹽酸,反應(yīng)后的氣體又該如何除雜? 答:通過足量堿石灰(CaO和NaOH的混合物)
歡迎使用手機、平板等移動設(shè)備訪問中考網(wǎng),2025中考一路陪伴同行!>>點擊查看