來源:網絡資源 2022-12-10 22:02:41
✦空氣
一、空氣成分的研究史
1.18世紀70年代,瑞典科學家舍勒和英國的科學家化學家普利斯特里,分別發現并制得了氧氣。
2.法國科學家拉瓦錫最早運用天平作為研究化學的工具,用定量的方法研究了空氣的成分,第一次明確提出了“空氣是由氧氣和氮氣組成的”。其中氧氣約占空氣總體積的1/5的結論。
二、空氣中氧氣成分的測定
1.實驗現象:
A.紅磷燃燒發出黃白色火焰,放出熱量,冒出白色濃煙
B.(過一會兒白煙消失,裝置冷卻到室溫后打開彈簧夾)燒杯內的水倒流入集氣瓶,約占瓶子容積的1/5。
2.實驗結論:
說明空氣不是單一的物質;氧氣約占空氣總體積的1/5。
3.原理
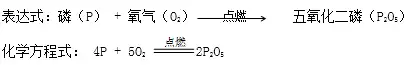
4.注意事項:
A.所用的紅磷必須過量,過少則氧氣沒有全部消耗完
B.要等集氣瓶(裝置)冷卻后才能打開彈簧夾,
C.裝置的氣密性要好,(否則測量結果偏小),
D.要先夾住橡皮管,然后再點紅磷(否則測量結果偏大)。
E.點燃紅磷伸入瓶中要立即塞緊瓶塞(否則測量結果偏大)。
思考:
(1)可否換用木炭、硫磺、鐵等物質?如能,應怎樣操作?
答:不能用木炭或蠟燭(燃燒產生了氣體,瓶內體積變化小),不能用鐵(鐵在空氣中不能燃燒)
(2)可否用鎂代替紅磷?
不能用鎂,因為鎂不但跟氧氣反應而且還跟氮氣等反應,結果測得的不只是空氣中氧氣的體積。會遠遠大于氧氣的體積。
5..實際在實驗中測得的結果比真實值小
其原因可能是A.紅磷量不足;B.裝置氣密性差;C.未冷卻至室溫就打開止水夾;D.沒有預先在導管中裝滿水
三、空氣的主要成分
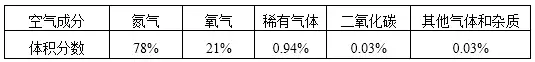
按體積分數:
氮氣(N2)78%,
氧氣(O2)21%(氮氣比氧氣約為4:1),
稀有氣體0.94%,
二氧化碳(CO2)0.03%,
其它氣體和雜質0.03%。
空氣的成分以氮氣和氧氣為主,屬于混合物。
空氣成分口訣:
氮七八氧二一,零點九四是稀氣;
零點零三有兩個,二氧化碳和雜氣。
四、物質的分類
純凈物和混合物
1.純凈物:
由一種物質組成的,“純凈”是相對的,絕對純凈的物質是沒有的,只要雜質含量低,不至于對生產和科學研究產生影響的物質就是純凈物。
2.混合物:
兩種或多種物質組成的,這些物質相互間沒有發生化學反應,各物質都保持各自的性質。
注意:劃分純凈物、混合物的標準是根據物質的種類來劃分的。只含一種物質的就屬于純凈物,含有幾種物質的就屬于混合物
五、空氣是一種寶貴的資源
1.氮
無色、無味的氣體,不溶于水,不燃燒也不支持燃燒,不能供給呼吸,化學性質不活潑。
2.稀有氣體:
無色、無味的氣體,通電時能發出不同顏色的光,化學性質很不活潑。

六、空氣的污染及防治
1.造成空氣污染的物質:
有害氣體(一氧化碳(CO)、二氧化氮(NO2)、二氧化硫(SO2))和煙塵。
2.污染來源:
空氣中的有害物質來自化石燃料的燃燒,石油化工廠排放的廢氣及汽車排放的尾氣。
3.被污染的空氣帶來的危害:
損害人體健康、影響作物生長、破壞生態平衡。
存在的環境問題:溫室效應(二氧化碳含量過多引起)、臭氧空洞(飛機的尾氣、氟里昂的排放)、酸雨(由二氧化硫、二氧化氮引起)。
4.防止空氣污染的措施:加強大氣質量監測,改善環境狀態、植樹造林、使用清潔能源。
5.目前空氣污染指數包括:一氧化碳、二氧化氮、二氧化硫、可吸入顆粒物、臭氧。
七、未來化學
將朝著“綠色化學”——“綠色消毀”和“綠色生產”的方向發展。核心是利用化學原理從源頭消除污染。
特點:
①充分利用資源和能源,原料無毒無害
②減少向環境排放廢物
③原料中的原子全部被消納,實現零排放(在化合反應中體現)
④生產出環境友好產品。
✦氧氣
一、氧氣的物理性質
1.色、味、態:通常情況下,是無色無味的氣體;
2.密度:標準狀況下,密度為1.429g/L,略大于空氣。(可用向上排空法)
3.溶解性:氧氣不易溶于水。(可用排水法收集)
4.三態變化:降溫后,氧氣可以變為淡藍色的液體,甚至淡藍色雪花狀固體。
二、氧氣的化學性質
(一)與非金屬(碳、硫、磷)的反應
1.木炭(黑色固體)燃燒
實驗現象:在氧氣中:劇烈燃燒,發出白光,放出熱量,生成一種無色無味氣體,該氣體能使澄清石灰水變渾濁。
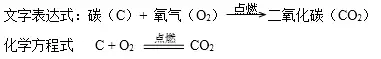
做木炭燃燒實驗時,燃燒匙應慢慢從瓶口向瓶底伸入(充分利用瓶內的氧氣)。
2.硫粉(淡黃色)燃燒:
實驗現象:在空氣中:發出微弱的淡藍色火焰;放出熱量、生成一種帶有刺激性氣味的氣體。
在氧氣中: 發出明亮的藍紫色的火焰, 放出熱量、生成一種帶有刺激性氣味的氣體。
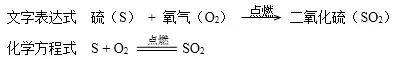
實驗時,要在瓶底裝少量水)吸收二氧化硫,防止污染空氣)。
3.紅磷(暗紅色固體)的燃燒
實驗現象:在空氣中:發出黃白色火焰,放出熱量,生成大量白煙
在氧氣中:劇烈燃燒,發出白光,放出熱量,生成大量的白煙

注意:五氧化二磷(P2O5)是固體,不是氣體
(二)與金屬(鎂、鐵)的反應
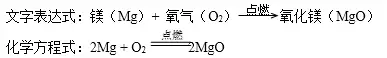
1.鎂帶(銀白色固體)在空氣中燃燒
實驗現象:劇烈燃燒,發出耀眼的白光,放出熱量,生成白色粉末狀固體。
2鐵絲(銀白色固體)在氧氣中燃燒
實驗現象:劇烈燃燒,火星四射,放出熱量,生成一種黑色固體。
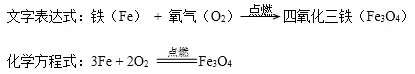
注意:集氣瓶底部鋪少量的細沙或加少量的水,防止生成的固體物質濺落瓶底,致使集氣瓶炸裂。鐵絲在空氣中不能燃燒
(三)與某些化合物(蠟燭、甲烷)的反應——產物均為:二氧化碳和水
實驗現象:比空氣中燃燒劇烈,發出白光,集氣瓶內壁出現水珠,有使澄清石灰水變渾濁的無色無味氣體產生。
![]()
空氣中燃燒情況:燃燒產生黃色火焰,放熱,稍有黑煙。
(四)其他物質與氧氣的反應
某些物質在一些條件下,與氧氣發生緩慢的氧化反應,成為緩慢氧化。緩慢氧化也放熱。
如:動植物新陳代謝,金屬的銹蝕,食物的腐爛、酒醋的釀造、農家肥的腐熟等等。
總結:
1.氧氣是一種化學性質比較活潑的氣體,在一定的條件下,能與許多物質發生反應并放出大量的熱。在這些反應中,氧氣提供氧,稱為氧化反應。氧氣便是常見的氧化劑;具有氧化性。
2.物質在純氧氣中燃燒程度比空氣中燃燒要劇烈。說明物質燃燒程度,與氧氣的濃度大小成正比;
3.物質燃燒時有的有火焰,有的會發光,有的會冒煙。一般來說,氣體燃燒會有火焰產生,固體直接燃燒,產生光或者火星。生成物有固體,一般都會產生煙,即固體小顆粒;
4.物質與氧氣反應不一定是燃燒現象,如緩慢氧化。
三、氧氣的用途
(1)供給呼吸:醫療上急救病人,登山、潛水、航空、宇航提供呼吸;
(2)支持燃燒:煉鋼、氣焊與氣接、液氧炸彈、火箭助燃劑

✦實驗室制取氧氣
一、工業制法
(分離液態空氣法)
原理:利用液態氧和液態氮的沸點不同。——物理變化(蒸餾)
(1)具體過程
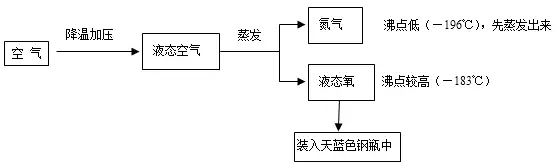
(2)注意:該過程是物理變化
二、氧氣的實驗室制法
(化學變化)
1.雙氧水(過氧化氫)制取氧氣
A.藥品:過氧化氫(H2O2)和二氧化錳(黑色粉末 MnO2)
B.實驗原理:
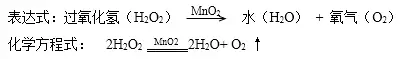
注:MnO2在該反應中是催化劑,起催化作用
C.裝置: 固體與液體反應,不需加熱(雙氧水的為一類)
注意事項:
①分液漏斗可以用長頸漏斗代替,但其下端應該伸入液面以下,防止生成的氣體從長頸漏斗中逸出;
②導管只需略微伸入試管塞
③氣密性檢查:用止水夾關閉,打開分液漏斗活塞,向漏斗中加入水,水面不持續下降,就說明氣密性良好。
④裝藥品時,先裝固體后裝液體
⑤該裝置的優點:可以控制反應的開始與結束,可以隨時添加液體。
D步驟:連、查、裝(二氧化錳)、定、倒(過氧化氫溶液)、收
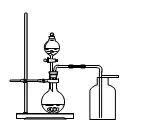
2.用高錳酸鉀、氯酸鉀制取氧氣
A.藥品:
高錳酸鉀(暗紫色固體)、氯酸鉀(白色固體)與二氧化錳(黑色粉末)
B.原理:
①加熱氯酸鉀(有少量的二氧化錳):
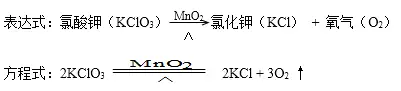
注意:MnO2在該反應中是催化劑,起催化作用
② 加熱高錳酸鉀:
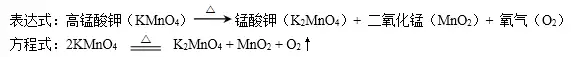
C.裝置:
加熱固體制氣體(加熱氯酸鉀的為一類)
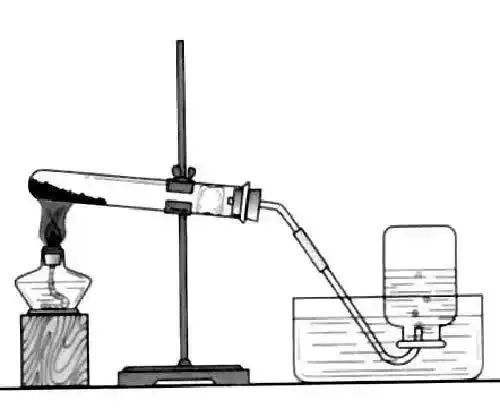
D.操作步驟:
(連)查、裝、定、點、收、離、熄。
① 連接裝置:先下后上,從左到右的順序。
② 檢查裝置的氣密性 :將導管的一端浸入水槽中,用手緊握試管外壁,若水中導管口有氣泡冒出,證明裝置不漏氣。松開手后,導管口出現一段水柱。
③ 裝入藥品:按粉末狀固體取用的方法(藥匙或紙槽)
④固定裝置 :固定試管時,試管口應略向下傾斜;鐵夾應夾在試管的中上部
⑤加熱藥品:先使試管均勻受熱,后在反應物部位用酒精燈外焰由前向后加熱。
⑥收集氣體:
a.若用排水集氣法收集氣體,當氣泡均勻冒出時再收集,剛排出的是空氣;水排完后,應用玻璃片蓋住瓶口,小心地移出水槽,正放在桌面上(密度比空氣大)(防止氣體逸出)
b.用向上排空法。收集時導管應伸入集氣瓶底部(為了排盡瓶內空氣)
用排水法收集時,導管放在集氣瓶口
⑦先將導管移出水面
⑧再停止加熱
E.易錯事項:
(1)試管口要略微向下傾斜:防止生成的水回流,使試管底部破裂。藥品應平鋪在試管底部
(2)導氣管伸入發生裝置內要稍露出橡皮塞:有利于產生的氣體排出。
(3)用高錳酸鉀制取氧氣時,試管口塞一團棉花:防止高錳酸鉀粉末進入導氣管,污染制取的氣體和水槽中的水。
(4)排氣法收集氣體時,導氣管要伸入接近集氣瓶底部:有利于集氣瓶內空氣排出,使收集的氣體更純。
(5) 實驗結束后,先將導氣管移出水面,然后熄滅酒精燈:防止水槽中的水倒流,炸裂試管。
F、收集方法:
① 排水法(不易溶于水)
② 向上排空法(密度比空氣大)
G、檢驗、驗滿
檢驗:用帶火星的木條伸入集氣瓶內,發現木條復燃,說明是氧氣;
驗滿:用帶火星的木條放在集氣瓶口,若木條復燃,證明已滿。
三、催化劑
1.概念:
在化學反應中能改變其他物質的反應速率(加快或變慢),但本身的化學性質和質量在反應前后沒有發生變化的物質。
2.特點:
兩不變(質量、化學性質)、一改變(反應速率)
注意:
①催化劑不能改變生成物的質量,不能決定反應的進行
②催化劑不是反應物、又不是生成物
③催化劑僅針對某一反應,并不是所有反應的催化劑
④某一反應的催化劑可能不只一種
3.
二氧化錳在一些反應中不只作催化劑,催化劑不一定就只有二氧化錳。(在過氧化氫溶液制取氧氣中,催化劑可以用硫酸銅溶液、氧化鐵、氧化銅、紅磚粉末)。
在氯酸鉀制取氧氣中,二氧化錳的質量和化學性質不變,但質量分數變大。
歡迎使用手機、平板等移動設備訪問中考網,2023中考一路陪伴同行!>>點擊查看