來源:網(wǎng)絡(luò)資源 2023-08-12 19:38:47
物質(zhì)的變化和性質(zhì)
1、物理變化和化學(xué)變化
(1)物理變化是沒有生成其他物質(zhì)的變化;
(2)物理變化宏觀上沒有新物質(zhì)生成,微觀上沒有新分子生成。化學(xué)式前后一定一樣。
(3)化學(xué)變化是變化時生成了其他物質(zhì)的變化。
(4)化學(xué)變化宏觀上有新物質(zhì)生成,微觀上有新分子生成。化學(xué)式前后不一定不一樣(金剛石變成石墨除外)。
(5)區(qū)別:A、從宏觀上看,是否生成了其他的物質(zhì)。
B、從微觀上看,發(fā)生物理變化時,只是構(gòu)成物質(zhì)的粒子(分子、原子、離子)之間的間隔發(fā)生了改變,粒子的本身沒有發(fā)生改變;發(fā)生化學(xué)變化時,構(gòu)成物質(zhì)的分子破裂,原子重新組合成新的分子,構(gòu)成新的物質(zhì)。
(6)聯(lián)系:在化學(xué)變化過程中,一定同時發(fā)生物理變化,而物理變化中不一定發(fā)生化學(xué)變化。
(7)判斷方法:宏觀方面是否有其他的物質(zhì)生成。微觀方面是否有新分子生成。
(8)“其他物質(zhì)”并不是指物質(zhì)的形狀和狀態(tài)的變化,而是組成和結(jié)構(gòu)的變化。
(9)在化學(xué)變化時,常伴隨有發(fā)光、發(fā)熱、變色、放出氣體、生成沉淀、爆炸等現(xiàn)象,這些現(xiàn)象只能作為判斷的輔助依據(jù),而不能作為判斷化學(xué)變化的標準。如燈泡通電發(fā)光發(fā)熱,無色的氧氣液化變成淡藍色的液體等都是物理變化。但是沒有現(xiàn)象不一定是沒發(fā)生化學(xué)變化。
(10)如果只是狀態(tài)或形狀的改變,一般是物理變化。
2、物質(zhì)性質(zhì)
(1)物理性質(zhì)包括物質(zhì)的顏色、狀態(tài)、氣味、熔點、沸點、硬度、密度、溶解性、揮發(fā)性、吸附性等。
(2)物理性質(zhì)也并不是只有物質(zhì)發(fā)生物理變化時才表現(xiàn)出來的性質(zhì);例如:木材具有密度的性質(zhì),并不要求其改變形狀時才表現(xiàn)出來。
(3)區(qū)分物理性質(zhì)和化學(xué)性質(zhì)時一定要抓住是否需要發(fā)生化學(xué)變化才能表現(xiàn)出來。
(
利用化學(xué)性質(zhì)與物理性質(zhì),不僅可以用來推斷物質(zhì)及其用途,而且可以鑒別具體的物質(zhì),等等.
第二單元課題1空氣
一、空氣:
1、第一個得出空氣組成的化學(xué)家:拉瓦錫(第一個用天平進行定量分析)。
2、空氣的成分按體積分數(shù)(不是質(zhì)量分數(shù))計算:氮氣78%,氧氣21%,稀有氣體0.94%,CO20.03%,其他氣體和雜質(zhì)。
3、空氣是混合物
4、空氣的污染:排放到空氣中的有害物質(zhì)主要是煙塵和有害氣體(CO、SO2、氮的氧化物)。
5、空氣的污染指數(shù)越大,空氣質(zhì)量級別越高,空氣質(zhì)量越差。
5、空氣中有害氣體主要來自化石燃料(煤和石油等)的燃燒和工廠的廢氣、汽車排放的尾氣等。
6、二氧化碳不是污染物。
7、工業(yè)上利用分離液態(tài)空氣制取氧氣,此變化是物理變化,不是分解反應(yīng)。
8、氮氣(1)化學(xué)性質(zhì)不支持燃燒,不能燃燒,
(2)用途:可作保護氣,燈泡中充入可延長使用壽命,食品包裝時充氮以防腐,可作制冷劑。
9、稀有氣體(1)化學(xué)性質(zhì)不活潑,(2)用途:常作保護氣,燈泡中充稀有氣體以使燈泡耐用,通電時會發(fā)出不同顏色的光,制造低溫環(huán)境。
二、空氣中氧氣含量的測定
(1)實驗原理:用紅磷燃燒消耗鐘罩內(nèi)的氧氣,導(dǎo)致鐘罩內(nèi)壓強減小,在大氣壓的作用下,水進入瓶內(nèi)占據(jù)減少的氧氣所占的空間,從而測定空氣中氧氣的體積分數(shù)。
(2)反應(yīng)式:4P+O22P2O5
(3)實驗步驟:
①連接裝置,并檢查裝置的氣密性。
立即
②點燃燃燒匙內(nèi)的紅磷,伸入集氣瓶中,并塞子。
熄滅并冷卻
③待紅磷后,彈簧夾。
(4)實驗現(xiàn)象:①紅磷燃燒,產(chǎn)生大量白煙;②放熱;③冷卻后打開彈簧夾,水沿著導(dǎo)管進入集氣瓶中,進入集氣瓶內(nèi)水的體積約占集氣瓶空氣總體積的五分之一。
(5)實驗結(jié)論:①O2約占1/5;②空氣是混合物;③N2約占4/5,不支持燃燒,也不能燃燒,難溶于水
(6)注意事項:
1>、可燃物要求:易燃燒,足量且產(chǎn)物是固體。
2>、裝置要求:氣密性良好
3>、在集氣瓶底加水的目的:吸收熱量,防止爆炸。
4>、不能否用鐵代替紅磷的原因:鐵不能在空氣中燃燒
5>、不能否用碳、硫代替紅磷的原因:因為硫、木炭燃燒生成二氧化硫、二氧化碳氣體,使壓強變化不大。
6>、不要用鎂代替紅磷的原因:鎂在空氣中燃燒時能與氮氣和二氧化碳發(fā)生反應(yīng),這樣不僅消耗氧氣,還消耗了氮氣和二氧化碳。
(7)實驗誤差
1>、液面上升小于1/5原因:
(1)裝置氣密性不好
(2)紅磷的量不足
(3)裝置未冷卻就打開彈簧夾
(4)瓶內(nèi)含有殘余的氧氣
2>、液面上升大于1/5原因:
(1)在燃燒過程中未夾緊彈簧夾
(2)插入燃燒匙太慢,塞緊瓶塞之前瓶內(nèi)部分空氣受熱逸出
(8)實驗改進后的優(yōu)點:
裝置始終密封,實驗結(jié)論更準確,避免白煙擴散到空氣中污染環(huán)境,更環(huán)保。
三、氧氣
1、氧氣的組成:由氧元素組成的單質(zhì)
2、氧氣的構(gòu)成:一個氧分子由兩個氧原子構(gòu)成的,或者氧氣是由氧分子構(gòu)成的。
3、氧氣的物理性質(zhì):無色無味,不易溶于水,密度比空氣的略大。液氧、固態(tài)氧淡藍色。
4、氧氣的化學(xué)性質(zhì):氧氣是一種化學(xué)性質(zhì)比較活潑的氣體,能跟許多物質(zhì)發(fā)生化學(xué)反應(yīng),具有氧化性,能支持燃燒,有助燃性。
5、木炭
1》操作:用坩堝鉗夾取一小塊木炭,在酒精燈上加熱到發(fā)紅,由瓶口向下緩慢插入到盛有氧氣的集氣瓶中(原因是為了保證有充足的氧氣支持木炭燃燒)
2》現(xiàn)象:(1)發(fā)出白光,(2)生成使石灰水變渾濁的氣體
3》表達式:C+O2====CO2
6、硫
1》現(xiàn)象:(1)硫在空氣里燃燒發(fā)出微弱的淡藍色火焰,在氧氣里燃燒發(fā)出藍紫色火焰,(2)產(chǎn)生有刺激性氣味的氣體。
2》表達式:S+ O2====SO2
3》注意點:預(yù)先放入少量水或少量的氫氧化鈉溶液,吸收SO2,防止空氣污染
7、鐵絲
1》實驗操作:把光亮的細鐵絲盤成螺旋狀,下端系一根火柴,點燃火柴,待火柴快燃盡時,由上向下緩慢插入盛有氧氣的集氣瓶中(為了防止細鐵絲燃燒時放熱使氧氣從集氣瓶口逸出,保證有充足的氧氣與細鐵絲反應(yīng))。
2》現(xiàn)象:在氧氣中燃燒現(xiàn)象:(1)劇烈燃燒,火星四射,(2)生成黑色固體。
3》表達式:3Fe+2O2====Fe3O4
4》注意:
①用砂紙把細鐵絲磨成光亮的銀白色,是為了除去細鐵絲表面的雜質(zhì)。
②將細鐵絲盤成螺旋狀,是為了增大細鐵絲與氧氣的接觸面積。③把細鐵絲繞在火柴上,是為了引燃細鐵絲。
④待火柴快燃盡時才緩慢插入盛有氧氣的集氣瓶中,是為了防止火柴燃燒時消耗氧氣,保證有充足的氧氣與細鐵絲反應(yīng)。
⑤集氣瓶里要預(yù)先裝少量水或在瓶底鋪上一薄層細沙,是為了防止灼熱的生成物濺落使集氣瓶瓶底炸裂。
8、氧氣的利弊
1、有害的方面:食物的腐敗,鋼鐵生銹;
2、有利的方面:釀酒,釀醋,呼吸作用
9、氧氣的用途
氣焊、航天、潛水、登山、醫(yī)療、液氧炸藥、煉鐵、煉鋼
氧氣制取
一、氧氣的工業(yè)制備
1、分離液態(tài)空氣法(原理:利用N2、O2的沸點不同,N2先被蒸發(fā),余下的是液氧(貯存在天藍色鋼瓶中)(這是物理變化,不是分解反應(yīng))
2、膜分離法
二、實驗室制氧氣
(一)、原理
MnO2
2H2O2=====2H2O+ O2↑
△
2KMnO4====K2MnO4+MnO2+ O2↑
MnO2
2KClO3======2KCl+3O2↑
△
(二)、裝置
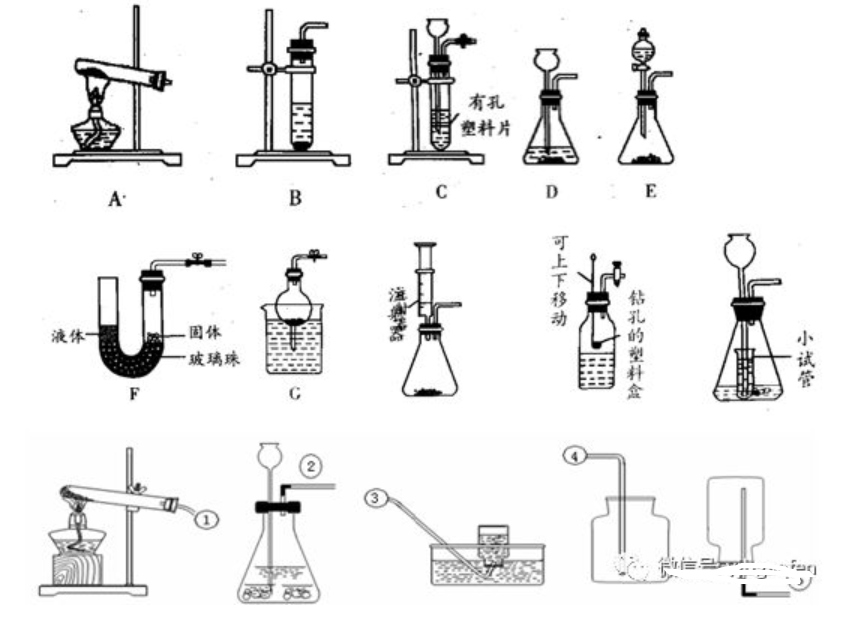
1、發(fā)生裝置:選擇的依據(jù)(或者考慮的因素)是反應(yīng)物的狀態(tài)和反應(yīng)條件
固體,需加熱)
(1)固固加熱型(反應(yīng)物是
固體與液體,不需要加熱)
(2)固液不需加熱型(反應(yīng)物是
2、收集裝置:選擇的依據(jù)(或者考慮的因素)是氣體的密度和溶解性
(1)密度比空氣大用向上排空氣法(這種收集方法收到氣體不純,但干燥)
(2)難溶或不溶于水用排水法(這種收集方法收到的氣體純凈)
3、裝置的優(yōu)點:(1)便于添加液體(2)操作簡單(3)控制反應(yīng)速率(或控制反應(yīng)的發(fā)生或停止)
4、氣密性的檢驗:
A、把導(dǎo)管的一端放入盛水的燒杯中,用手緊貼容器外壁,觀察到導(dǎo)管口有氣泡產(chǎn)生,則裝置不漏氣。

B、錐形瓶與長頸漏斗
方法一:松開彈簧夾,從長頸漏斗處注水,使之下端管口浸人水中,再把導(dǎo)管放入裝有水的燒杯中,用兩手緊貼錐形瓶外壁,如果導(dǎo)管口有氣泡冒出,放開手后有少量水進人導(dǎo)管形成一段水柱,說明裝置不漏氣。
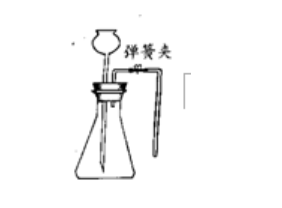
方法二:夾緊彈簀夾,從長頸漏斗處注水,使之下端管口浸入水中,繼續(xù)加水形成一段水柱,與錐形瓶內(nèi)液體產(chǎn)生液面差,且在一段時間內(nèi)水柱不發(fā)生回落,說明裝置不漏氣。
C、長頸漏斗與注射器從長頸漏斗處注水,使之下端管口浸人水中。若往外拉注射器活塞,發(fā)現(xiàn)長頸漏斗下端冒出氣泡,則裝置氣密性良好;若往里推活塞,發(fā)現(xiàn)長頸漏斗內(nèi)形成段穩(wěn)定的水柱,則裝置氣密性良好。

(三)、操作制取氧氣的操作步驟和注意點(以高錳酸鉀制取氧氣并用排水法收集為例)
步驟:查裝定點收移熄
1、連接儀器(從下到上,從左到右)
2、檢驗氣密性
3、裝藥品
4、固定裝置
5、點燃
6、收集氣體
7、撤離導(dǎo)管
8、熄滅酒精燈
(四)、驗滿:
1、如果用向上排空氣法收集,驗滿方法是用帶火星的木條放在集氣瓶口,木條復(fù)燃說明已滿。
2、如果用排水法收集,驗滿方法是看到水槽中有氣泡
(五)、檢驗:用帶火星的木條伸入集氣瓶內(nèi),木條復(fù)燃說明是氧氣。
(六)、注意事項
①試管口應(yīng)略向下傾斜(防止藥品中殘存的水分受熱變成水蒸氣,遇冷倒流回試管底部,使試管炸裂。)
②藥品平鋪在試管的底部(增加物質(zhì)的受熱面積。)
③鐵夾應(yīng)夾在離試管口的1/4~1/3處(便于預(yù)熱)
④導(dǎo)管應(yīng)稍露出橡皮塞(便于氣體排出)
⑤試管口應(yīng)放一團棉花:防止高錳酸鉀粉末進入導(dǎo)管
⑦用排水法收集氧氣時,當(dāng)導(dǎo)管口剛產(chǎn)生氣泡時不能立即收集,待導(dǎo)管口有連續(xù)均勻的氣泡冒出時再收集。因為開始時排出的氣泡里空氣,若此時收集,則氧氣不純。
⑧若用向上排空氣法收集,導(dǎo)管伸到集氣瓶的底部,便于空氣排出。
⑨收集滿氧氣的集氣瓶要正放,瓶口處蓋上玻璃片。
⑩實驗結(jié)束時,先移導(dǎo)管再熄滅酒精燈(防止水倒吸引起試管破裂)
9、以氧氣為核心的轉(zhuǎn)化關(guān)系圖

催化劑
改變
1、定義:指在化學(xué)變化里能夠化學(xué)反應(yīng)的,而本身的在反應(yīng)前后都沒有發(fā)生變化的物質(zhì)叫做催化劑;催化劑在化學(xué)反應(yīng)中的作用叫催化作用。
2、催化劑基本特征是“一變兩不變”
3、“一變”指的是改變反應(yīng)速率,“改變”包括“加快”和“減慢”
4、“二不變”指的是質(zhì)量和化學(xué)性質(zhì)不變,(不是性質(zhì),也不是物理性質(zhì))
5、使用催化劑能使化學(xué)反應(yīng)的速率不一定加快,也可能減慢
6、使用催化劑不能增加生成物的質(zhì)量,而生成物的質(zhì)量是由反應(yīng)物的質(zhì)量決定的。
7、二氧化錳不一定是用作任何反應(yīng)的催化劑
8、一個反應(yīng)的催化劑可以有多種。實驗室用過氧化氫制氧氣可能用二氧化錳可硫酸銅溶液作催化劑
9、催化劑不是化學(xué)反應(yīng)的必要條件,它只改變化學(xué)反應(yīng)的速率,而不能決定能否發(fā)生化學(xué)反應(yīng)。如沒有催化劑,將過氧化氫加熱也能反應(yīng)放出氧氣。
10、催化劑是參加化學(xué)反應(yīng)的,但是它只是與反應(yīng)物反應(yīng)生成中間產(chǎn)物,反應(yīng)結(jié)束后,又恢復(fù)為相同質(zhì)量的原物質(zhì),并沒有生成其他物質(zhì),也就是說沒有生成新物質(zhì),因此催化劑只能是反應(yīng)的一個條件,而不能是反應(yīng)物。
11、催化劑在使用時,并不是越多越好。
12、高錳酸鉀雖能改變氯酸鉀制取氧氣的反應(yīng)速率,但不是催化劑,因為它的質(zhì)量和化學(xué)性質(zhì)都發(fā)生了改變。
13、使用過的催化劑通過過濾、洗滌、干燥再回收利用
14、探究某種物質(zhì)是不是“催化劑”時,一定要同時滿足三個條件:即(1)反應(yīng)速率(2)前后質(zhì)量(3)前后化學(xué)性質(zhì)
反應(yīng)類型
(一)化合反應(yīng)
1、化合反應(yīng):把兩種或兩種以上物質(zhì)生成另一種物質(zhì)的反應(yīng)
2、化合反應(yīng):特征是“多”變“一”。
3、表示形式:A+B+……→C。
4、化合反應(yīng)屬于基本反應(yīng)類型中的一種。
5、反應(yīng)中各元素的化合價不一定改變。
6、反應(yīng)物不一定有單質(zhì),生成物一定是化合物。
(二)分解反應(yīng)
1、定義:由一種反應(yīng)物生成兩種或兩種以上其他物質(zhì)的反應(yīng)
2、特征是“一”變“多”。
3、表示形式:A→B+C+……
4、屬于是基本反應(yīng)類型中的一種,
5、反應(yīng)前后,各元素化合價不一定改變。
6、反應(yīng)物一定是化合物,生成物中不一定有單質(zhì)。
(三)氧化反應(yīng)
1、氧化反應(yīng):物質(zhì)與氧之間的反應(yīng);
2、這里的“氧”不能換成“氧氣”,因為氧既包括單質(zhì)氧氣,又包括化合物中的氧。
3、有氧氣參加的反應(yīng)一定是氧化反應(yīng)
4、氧化反應(yīng)不一定有氧氣參加
5、氧化反應(yīng)不屬于基本反應(yīng)類型。
編輯推薦:

歡迎使用手機、平板等移動設(shè)備訪問中考網(wǎng),2025中考一路陪伴同行!>>點擊查看